
Генетические нарушения, передающиеся от поколения к поколению, принято считать (и не без оснований) несомненным злом. Однако, как это ни странно звучит, некоторые такие наследственные патологии могут принести неожиданную пользу.
Оказывается, определенные генетические нарушения обеспечивают устойчивость к конкретным вирусным или инфекционным заболеваниям.
Эта устойчивость может наблюдаться как у людей, которые являются лишь носителями мутантного гена, так и у тех, у кого развились соответствующие генетические болезни.
Иногда только один родитель «повинен» в передаче так называемого дефектного гена, который создает предпосылки для устойчивости к вирусам и инфекциям. Иногда – оба. В итоге это напоминает ситуацию, когда определенные болезнетворные патогены приводят к появлению у человека сопротивляемости к другим инфекциям.
Ниже представлен перечень болезней, которые, как было доказано, способны до определенной степени защищать организм от разных вирусов и инфекционных заболеваний. При этом некоторые из перечисленных ниже вирусов остаются неизлечимыми.
Именно поэтому изучение факторов, которые приводят к возникновению сопротивляемости к патогенным микроорганизмам, способно помочь исследователям создать более эффективные виды лечения. Итак, представляем вашему вниманию десять заболеваний (не только генетических), которые способны предотвратить возникновение других болезней.
Генетические заболевания против вирусов и инфекций
Серповидноклеточная анемия и малярия
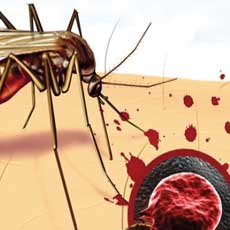 Люди, которые являются носителями генетической аномалии, приводящей к появлению серповидных эритроцитов (то есть, к наследственной серповидноклеточной анемии), оказались более устойчивыми к такому заболеванию, как малярия, передающейся через укус инфицированного комара.
Люди, которые являются носителями генетической аномалии, приводящей к появлению серповидных эритроцитов (то есть, к наследственной серповидноклеточной анемии), оказались более устойчивыми к такому заболеванию, как малярия, передающейся через укус инфицированного комара.
Серповидноклеточная анемия – это наследственное состояние, которое проявляется в деформации красных кровяных клеток (эритроцитов); последние имеют специфическую серпообразную (удлиненную) форму, что с большей вероятностью может приводить к закупорке сосудов.
Получается, что носители гена серповидноклеточной анемии практически невосприимчивы к малярии. При этом носителями этого гена являются 0,5% населения всей планеты. Наибольшее число таких людей проживает в зонах повышенного риска заражения малярией (Центральная и Южная Америка, Африка, Азия и некоторые прибрежные регионы Индийского и Тихого океанов).
Механизм, благодаря которому серповидные эритроциты невосприимчивы к малярии, связан с составом гемоглобина – железосодержащего белка, являющегося одним из компонентов эритроцитов. У людей с серповидными эритроцитами образуется особая форма гемоглобина – гемоглобин S.
В деформированных эритроцитах содержится меньше гема, являющегося небелковой частью гемоглобина. Пониженное содержание гема стимулирует образование фермента под названием гемоксигеназа, который, в свою очередь, приводит к разрушению гема.
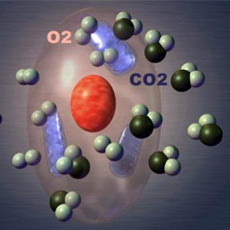 В результате этого порочного круга в крови увеличивается содержание углекислого газа, чему способствует вышеназванный фермент. Именно данный процесс и играет важнейшую роль в предотвращении малярии.
В результате этого порочного круга в крови увеличивается содержание углекислого газа, чему способствует вышеназванный фермент. Именно данный процесс и играет важнейшую роль в предотвращении малярии.
Наличие мутации генов, приводящей к образованию серповидных эритроцитов, может проходить бессимптомно. Но и больные серповидноклеточной анемией вполне могут прожить до старости (при надлежащем лечении). Понимание процесса ученые пытаются использовать для создания новых препаратов против малярии.
Заболевание Тея-Сакса и туберкулез
 Носители мутантного гена, приводящего к заболеванию Тея-Сакса, согласно исследованиям, демонстрируют стойкость к такому виду микобактерий, как Mycobacterium tuberculosis (палочка Коха), вызывающему туберкулез.
Носители мутантного гена, приводящего к заболеванию Тея-Сакса, согласно исследованиям, демонстрируют стойкость к такому виду микобактерий, как Mycobacterium tuberculosis (палочка Коха), вызывающему туберкулез.
Болезнь Тея-Сакса (ранняя детская амавротическая идиотия) разрушает нервные клетки головного и спинного мозга. Наиболее распространено это редкое наследственное заболевание у евреев-ашкеназов (вероятно, из-за обособленности и малой миграции этой субэтнической группы евреев).
Наиболее ярко эта связь между широким распространением мутации гена, повинного в болезни Тея-Сакса, и высокой сопротивляемостью к туберкулезу прослеживается именно в этой конкретной культурной общности.
Ранняя детская амавротическая идиотия проявляется в прогрессирующем ухудшении работы мозга и физических возможностей. В случае детской формы болезни пациент умирает в возрасте до трех-четырех лет. Существуют также подростковая форма (смерть наступает в возрасте до 16-ти лет) и взрослая форма (больные доживают максимум до 30-ти лет).
У носителей мутантного гена вырабатывается фермент, который называется гексозаминидаза А. Этот фермент, как доказано, участвует в процессах, препятствующих распространению туберкулеза, так как способен разрушать соответствующий вид микобактерий.
Фермент приводит к разрушению клеточной поверхности вышеупомянутой микобактерии, из-за чего она становится менее активной. Благодаря этому, даже в периоды всплесков туберкулезной инфекции, случаи смерти по причине данного заболевания среди евреев-ашкеназов были довольно редки.
 Заболевание кистозный фиброз или муковисцидоз, вызываемое мутацией соответствующего гена, проявляется также в устойчивости носителей данного гена к распространению летального штамма холеры под названием холерный вибрион (Vibrio cholerae).
Заболевание кистозный фиброз или муковисцидоз, вызываемое мутацией соответствующего гена, проявляется также в устойчивости носителей данного гена к распространению летального штамма холеры под названием холерный вибрион (Vibrio cholerae).
Кистозный фиброз приводит к тяжелейшим нарушениям в функционировании органов дыхания пациента, обусловленным, кроме прочего, выработкой в бронхах очень густой слизи. Это слизисто-гнойное образование разрастается в дыхательной системе, создавая благоприятную почту для существований бактериальной инфекции.
Также болезнь поражает пищеварительную систему, блокируя образование ферментов, необходимых для усваивания пищи в тонком кишечнике. Не у всех носителей мутантного гена диагностируется кистозный фиброз; вероятность этого заболевания у детей, родившихся от двух родителей-носителей, доходит до 25-ти процентов.
Однако эти же носители демонстрируют стойкость к холере – смертельному заболеванию, в период развития которого больной человек теряет до 19-ти литров воды ежесуточно, что в конечном итоге приводит к дегидратации.
Если говорить упрощенным языком, то кистозный фиброз блокирует так называемые хлоридные каналы (белки, которые выполняют важнейшие функции регулирования веществ в клеточных мембранах), удерживая жидкость.
Как результат, даже носители только одного мутантного гена, не болеющие кистозным фиброзом, в случае заражения холерным вибрионом теряют до половины вышеназванного количества жидкости в сутки.
Но даже этого ограниченного выделения жидкости оказывается достаточно для вымывания холерного токсина из организма без того, чтобы привести больного к обезвоживанию. Таким образом, наличие одного дефектного гена, ответственного за муковисцидоз, значительно увеличивает шансы на выживаемость при холере, так как приостанавливает процесс обезвоживания.
Мутации генов против туберкулеза
Кистозный фиброз и туберкулез
 Итак, наличие кистозного фиброза действительно способно защитить от холеры – заболевания, от которого, как известно, ежегодно умирает от 20-ти до 140-ка тысяч человек. Однако тяжесть симптомов при кистозном фиброзе и высокая летальность (особенно среди детей раннего возраста) вряд ли позволяют оправдать эту наследственную болезнь.
Итак, наличие кистозного фиброза действительно способно защитить от холеры – заболевания, от которого, как известно, ежегодно умирает от 20-ти до 140-ка тысяч человек. Однако тяжесть симптомов при кистозном фиброзе и высокая летальность (особенно среди детей раннего возраста) вряд ли позволяют оправдать эту наследственную болезнь.
Однако вовсе не холера ответственна за гибель почти двух миллионов людей на нашей планете ежегодно. Такое количество жизней уносит туберкулез, входя в десятку лидирующих причин смерти во всем мире. Но при чем тут туберкулез?
Дело в том, что носители одного мутировавшего гена, ответственного за кистозный фиброз, не только не болеют этим заболеванием, но и демонстрируют повышенную стойкость к туберкулезу. Высокий уровень смерти от последнего повышает значимость факта наличия такой мутации вообще в деле поиска лечения от туберкулеза.
Парадоксальная ситуация заключается в том, что люди, которые появились на свет от обоих гетерозиготных родителей (то есть от двух носителей мутировавшего гена), вряд ли успеют передать этот ген потокам, скончавшись до наступления взросления.
Болезнь Феллинга и выкидыш
 Согласно результатам различных исследований, среди женщин, которые являются носителями гена, отвечающего за болезнь Феллинга, отмечается гораздо меньшая вероятность риска выкидышей. Болезнь Феллинга (фенилкетонурия) – это наследственное заболевание, при котором нарушается выработка фенилаланина в организме.
Согласно результатам различных исследований, среди женщин, которые являются носителями гена, отвечающего за болезнь Феллинга, отмечается гораздо меньшая вероятность риска выкидышей. Болезнь Феллинга (фенилкетонурия) – это наследственное заболевание, при котором нарушается выработка фенилаланина в организме.
Это не единственная аминокислота, к нарушению метаболизма которой приводит данное заболевание, но именно накопление фенилаланина приводит к тому, что люди с диагнозом «болезнь Феллинга» нуждаются в больших количествах белка.
Организм больных оказывается неспособен к выработке ферментов, разрушающих фенилаланин, перепроизводство которого организмом может приводить к летальному исходу. Но, хотя фенилкетонурия представляет серьезную угрозу для здоровья, носители соответствующего мутированного гена получают одно преимущество.
Преимущество это заключается в том, что женщины-носители деформированного гена, приводящего к болезни Феллинга, больше защищены от вероятности выкидыша из-за инфекционных факторов, которые являются вторыми среди причин, приводящих к выкидышу вообще.
Эта зависимость особенно заметна в тех странах мира, где окружающая среда благоприятствует распространению грибковых инфекций, некоторые из которых могут стать причиной выкидышей. К тому же носители соответствующих генов, ответственных за выработку повышенного количества фенилаланина, лучше сопротивляются грибковым инфекциям.
Таким образом, именно фенилаланин, который приводит к фенилкетонурии, проявляет сопротивляемость к большинству токсинов многих грибковых инфекций, являющихся причинами самопроизвольных абортов (собственно, выкидышей).
 Существует связь между пациентами, страдающими от тяжелой миастении и предотвращением такого неизлечимого заболевания вирусной природы, как бешенство. Тяжелая миастения – это заболевание, поражающее нервную и мышечную ткань пациента.
Существует связь между пациентами, страдающими от тяжелой миастении и предотвращением такого неизлечимого заболевания вирусной природы, как бешенство. Тяжелая миастения – это заболевание, поражающее нервную и мышечную ткань пациента.
Миастения характеризуется патологической мышечной усталостью, при которой поперечнополосатые мышцы больного человека при утомляемости демонстрируют состояние, сходное с параличом. Причина патологии заключается в нарушении в работе нейронов нервно-мышечной системы организма.
Распространение же бешенства по нервной системе человека также чаще всего начинается через скелетные мышцы; причина этого вполне очевидна – сам вирус бешенства попадает в организм зараженного посредством укусов животных мягких тканей и мышц.
Из-за вышеописанной наиболее вероятной схемы проникновения бешенства в организм, люди, которые страдают от тяжелой миастении, менее подвержены бешенству. Это происходит из-за нарушения работы нервно-мышечных синапсов.
 Для вируса бешенства представляется сложной задачей повреждение нервной системы, если он не в состоянии проникнуть в нее в первую очередь. Этот вирус не всегда достигает центральной нервной системы именно через мышечные ткани, чаще он использует периферическую нервную систему для продвижения.
Для вируса бешенства представляется сложной задачей повреждение нервной системы, если он не в состоянии проникнуть в нее в первую очередь. Этот вирус не всегда достигает центральной нервной системы именно через мышечные ткани, чаще он использует периферическую нервную систему для продвижения.
Вероятность сочетания этих двух событий – тяжелой миастении и укуса бешеного животного – мала. Однако, говоря о гипотетической возможности, подобная специфика распространения данного смертельно опасного инфекционного заболевания позволит пациентам с миастенией предотвратить бешенство, или даст больше времени для того, чтобы человек обратился за медицинской помощью.
Генетические заболевания против вирусов
Болезнь Ниманна-Пика и лихорадка Эбола
Болезнь Ниманна-Пика является заболеванием наследственной природы, которое выражается в ненормальном накоплении холестерина (главным образом) в клеточном органоиде, называемом лизосомой.
Накопление холестерина, как и других липидных веществ, происходит по причине нехватки определенного белка – NPC1, который отвечает за вывод холестерина из лизосом. Однако было также доказано, что этот же белок – NPC1 – связан с распространением эболавируса.
Существуют результаты исследований, согласно которым вирус Эбола с меньшей интенсивностью инфицирует клетки соединительной ткани (фибробласты) пациентов, которые страдают от липоидного гистиоцитоза (то есть от болезни Ниманна-Пика).
В то же самое время, если фибробласты содержат в избытке белок NPC1, тогда вирусу Эбола проще инфицировать организм. Иными словами, именно дефицит белка NPC1 в организме людей с диагнозом «болезнь Ниманна-Пика» затрудняет заражением эболавирусом этих людей.
Болезнь Ниманна-Пика и геморрагическая лихорадка Марбург
 Аналогично ситуации с вирусом Эбола, благодаря болезни Ниманна-Пика у пациентов с этим диагнозом отмечается устойчивость к геморрагической лихорадке Марбург, являющейся высоколетальным острым вирусным заболеванием.
Аналогично ситуации с вирусом Эбола, благодаря болезни Ниманна-Пика у пациентов с этим диагнозом отмечается устойчивость к геморрагической лихорадке Марбург, являющейся высоколетальным острым вирусным заболеванием.
Высокий уровень смертности при данном заболевании (его еще называют «болезнью зеленых мартышек» и церкопитековой болезнью), как и при лихорадке Эбола, обусловлен схожестью этих вирусов (они оба являются представителями семейства филовирусов).
Болезнь Марбурга приводит к геморрагии (то есть к кровоизлияниям) с большой потерей крови, поражению внутренних органов и центральной нервной системы пациента. Лечение данного заболевания протекает очень тяжело, а уровень летальности иногда доходит до 90 процентов.
Практически так же, как и в случае с лихорадкой Эбола, пациенты с диагнозом «болезнь Ниманна-Пика» демонстрируют устойчивость к геморрагической лихорадке из-за дефицита белка NPC1. Его недостаток в организме не дает возможности филовирусам репродуцироваться и распространяться.
Соответственно, поскольку вирусы данного семейства не имеют возможности распространяться, пациенту, страдающего от болезни Ниманна-Пика, гораздо проще сопротивляться данному заболеванию и излечиться от него.
Врожденное нарушение гликозилирования гликопротеидов 2b типа и вирусные инфекции
 Столь сложное название данного состояния – врожденное нарушение гликозилирования 2b типа – означает, по сути, целую группу довольно редких заболеваний наследственного типа, проявляющихся в различных специфических нарушениях процессов метаболизма в организме. Для этого нарушения иногда используют следующую английскую аббревиатуру – CDG-2b.
Столь сложное название данного состояния – врожденное нарушение гликозилирования 2b типа – означает, по сути, целую группу довольно редких заболеваний наследственного типа, проявляющихся в различных специфических нарушениях процессов метаболизма в организме. Для этого нарушения иногда используют следующую английскую аббревиатуру – CDG-2b.
Как показали исследования, наличие этой группы наследственных патологий способно стать фактором, предотвращающим распространение таких вирусных инфекций, как вирус иммунодефицита человека, вирус гриппа, герпес и вирус гепатита С.
Причина того, что при врожденном нарушении CDG-2b у пациента появляется сопротивляемость к вирусным инфекциям, заключается в присутствии в организме фермента, возникающего в процессе переработки определенной группы олигосахаридов, играющих важную роль для здоровой микрофлоры нашего кишечника.
Иными словами, происходит нарушение процесса синтеза гликопротеинов. Процесс же распространения вирусов, как известно, связан с процессом гликозилирования клеток (процесса, в результате которого образуются гликолипиды и гликопротеины).
 Поскольку гликозилирование у пациентов с CDG-2b нарушено, это препятствует поддержанию жизнедеятельности вирусов. Исследования показывают, что люди с нарушением CDG-2b реагируют нормально на так называемые нерепликационные вирусы.
Поскольку гликозилирование у пациентов с CDG-2b нарушено, это препятствует поддержанию жизнедеятельности вирусов. Исследования показывают, что люди с нарушением CDG-2b реагируют нормально на так называемые нерепликационные вирусы.
Зато «живые вирусы», которые проходят все стадии репликации (размножения) в общем виде (то есть размножение которых строится на процессах гликозилирования), на таких людей не воздействуют. Знание этого механизма позволяет создавать препараты, воздействующие на так называемую вирусную оболочку некоторых вирусов.
Лечение рака с помощью коровьей оспы
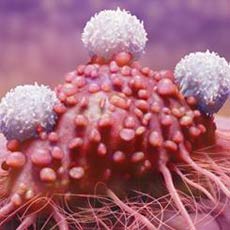 Поиск эффективных средств борьбы с раковыми заболеваниями по всему миру не останавливается, кажется, ни на минуту. Однако, как бы ни старались представители современной медицинской науки, на сегодняшний день самым эффективным средством борьбы с раковыми заболеваниями является их ранняя диагностика и лечение на самых ранних стадиях.
Поиск эффективных средств борьбы с раковыми заболеваниями по всему миру не останавливается, кажется, ни на минуту. Однако, как бы ни старались представители современной медицинской науки, на сегодняшний день самым эффективным средством борьбы с раковыми заболеваниями является их ранняя диагностика и лечение на самых ранних стадиях.
Увы, далеко не всегда удается выявить рак на ранней стадии развития, а посему врачам чаще всего предстоит бороться с болезнью уже на той стадии, когда он оказывается поражен многочисленными очагами заболевания, то есть метастазами.
На данном этапе пациентам остается жить считанные месяцы. Все, что может им предложить медицина, это немного продлить этот срок, а также попытаться уменьшить страдания больных людей. Впрочем, несколько лет назад наметился свет в конце тоннеля. И свет этот принес... вирус оспы.
На самом деле, идея использования вирусов в борьбе с раковыми клетками совсем не нова. Механизм данного процесса заключается в том, чтобы настроить защитный организм человека (иммунную систему) на борьбу с раковыми клетками, которые он считает своими, позволяя им распространяться дальше и дальше.
Искусственно внедренный вирус должен сам разрушить эти клетки, после чего он выводится из организма благодаря воздействию иммунной системы. Был проведен ряд исследований, в рамках которых пациентам с неоперабельным раком печени вводили модифицированный вирус натуральной оспы, используемый при вакцинировании.
В результате проведенных испытаний пациентам удалось продлить жизнь на срок от шести до 24 месяцев. И это при том, что с таким диагнозом люди обычно не живут больше трех месяцев. Результаты экспериментов воодушевили ученых на создание противораковой вакцины.
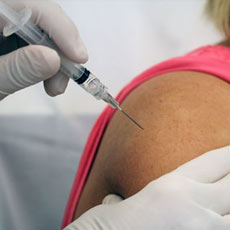 На сегодняшний день известно об удачных испытаниях американскими учеными данной вакцины, которые были проведены на подопытных мышах. Из 90 мышей сразу удалось полностью вылечить от рака 87 особей, а троих, у которых случился рецидив, удалось вылечить после повторного лечения.
На сегодняшний день известно об удачных испытаниях американскими учеными данной вакцины, которые были проведены на подопытных мышах. Из 90 мышей сразу удалось полностью вылечить от рака 87 особей, а троих, у которых случился рецидив, удалось вылечить после повторного лечения.
Судя по всему, впереди нас ожидают клинические испытания на людях, после которых, хочется надеяться, человечество впервые получит самое эффективное средство борьбы с различными раковыми заболеваниями даже на самых поздних стадиях развития.
Источник:
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Оставить отзыв
Нажимая кнопку "Отправить", в данной форме, Вы соглашаетесь с Пользовательским соглашением, а также с Соглашением об обработке персональных данных